Tóm tắt tài liệu
Hóa học lớp 10 là một trong những môn quan trọng đối với các bạn học sinh. Do đó để ôn tập một cách dễ dàng và vững chắc kiến thức, chúng tôi xin gửi đến các bạn bộ đề kiểm tra Hóa 10 học kì 2. Bộ tài liệu được chúng tôi sưu tầm một cách chọn lọc, qua đó hi vọng các bạn có thể sử dụng để có thể bồi dưỡng kiến thức cho mình.
Ma trận đề kiểm tra Hóa 10 học kì 2
Mỗi đề thi sẽ bao gồm 2 phần: Trắc nghiệm và tự luận. Hãy cố gắng làm xong trắc nghiệm hãy tiến vào các câu tự luận. Điều này giúp cho bạn giải quyết đề thi gọn gàng hơn rất là nhiều đấy.
Phân loại bài cấu trúc các đề kiểm tra
Đề thi hk2 hóa 10 trắc nghiệm
Câu 1: Chất nào sau đây tan trong nước nhiều nhất?
A. SO2
B. H2S
C. O2
D. Cl2
Câu 2: Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là:
A. O2
B. Cl2
C. SO2
D. O3
Câu 3: Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là
80
A. 4,48 lít
B. 6,72 lít
C. 5,6 lít
D. 2,24 lít
Câu 4: Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá – khử là:
A. 9
B. 8
C. 7
D. 6
Câu 5: Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là:
A. ns2np3
B. ns2np4
C. ns2np5
D. ns2np7
Câu 7: Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm h tinh bột, chất khí làm dung dịch chuyển màu xanh là:
A. O2
B. H2S
C. O3
D. O3 và O2
Câu 8: Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng:
A. Xuất hiện chất rắn màu đen
B. Chuyển sang màu nâu đỏ
C. Vẫn trong suốt, không màu
D. Bị v n đục, màu vàng.
Câu 9: Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa:
A. NaHSO3 1,2M.
B. Na2SO3 1M .
C. NaHSO3 0,4M và Na2SO3, 0,8M.
D. NaHSO3 0,5M và Na2SO3, 1M.
Câu 10: Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là:
A. Mg
B. Fe
C. Zn
D. Al
Câu 11: Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m?
A. 22,4 g
B. 32,0 g
C. 21,2 g
D. 30,2 g
Câu 12: Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A g m (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản ph m khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí).
A. 33,6 lit
B. 11,2 lít
C. 2,24 lít
D. 44,8 lít
Câu 13: Phương pháp để điều chế khí O2 trong phòng thí nghiệm là:
A. Điện phân H2O
B. Chưng cất phân đoạn không khí lỏng
C. Nhiệt phân KMnO4
D. Điện phân dung dịch NaCl
Câu 14: Nhận xét nào sau đây là không đúng?
A. Trong đời sống ozon dùng làm chất sát trùng nước sinh hoạt.
B. Ozon có tính oxi hóa mạnh hơn oxi.
C. Trong y học ozon được dùng để chữa sâu răng.
D. Ở điều kiện thường, ozon oxi hóa được vàng.
Câu 15: Cho 20 gam hỗn hợp g m Mg, MgO, Zn, ZnO, Al, Al2O3 tác dụng vừa đủ với dung dịch chứa 0,8 mol HCl thì thu được dung dịch X và 0,15 mol khí H2. Cô cạn dung dịch X thì khối lượng muối khan thu được là
A. 48,90 gam.
B. 30,65 gam.
C. 42,00 gam.
D. 44,40 gam.

Đề thi hóa lớp 10 học kì 2 tự luận
Câu 1: Cho 18,4 gam hỗn hợp g m Cu và Fe tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 7,84 lít khí SO2 (đktc, sản phẩm khử duy nhất) thoát ra.
- Tính phần trăm khối lượng các kim loại trong hỗn hợp đầu.
- Tính thể tích dung dịch NaOH 2M tối thiểu cần để hấp thụ hết lượng SO2 thoát ra ở thí nghiệm trên.
Câu 2: Hòa tan 22,8 gam hỗn hợp X g m Mg và Fe vào dung dịch H2SO4 98
a. Tính thành phần
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng.
Câu 3: Trình bày phương pháp hóa học phân biệt các dung dịch : NaCl , Na2SO4 , NaNO3 và H2SO4 đựng trong các lọ mất nhãn .
Câu 4: Sắp xếp các chất : Br2 , Cl2 , I2 theo thứ tự tính oxi hóa giảm dần . Viết phương trình phản ứng minh họa và cho biết vai trò các chất tham gia phản ứng .
Câu 5: Hòa tan hoàn toàn 15,2 gam hỗn hợp g m Fe và Cu trong dung dịch H2SO4 đặc , nóng , dư thì thu được 6,72 lít khí SO2 (đktc) .
a/ Viết các phương trình phản ứng xảy ra .
b/ Tính thành phần
Các dạng bài tập hóa 10 HK2
Bài tập hóa chương trình lớp 10 được phân thành nhiều dạng, một số dạng bài tập thường gặp nhất. Chúng ta chỉ cần ôn tập tốt các dạng bài tập này thì có thể dễ dàng giải quyết vấn đề hơn rất nhiều.
- Dạng bài tập lý thuyết đơn giản đọc sách giáo khoa sẽ hiểu rõ
- Nhận biết chất bằng chất thử khác nhau
- Thực hiện dãy chuyển hóa hóa học
- Tính phần khối lượng các chất trong hỗn hợp ban đầu.
Đáp án đề thi hóa 10 chương trình học kì 2
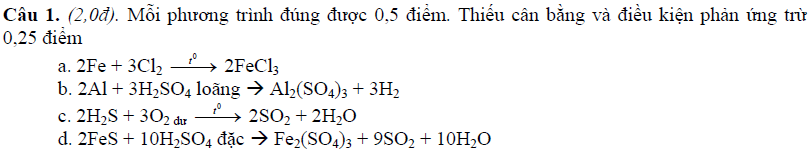


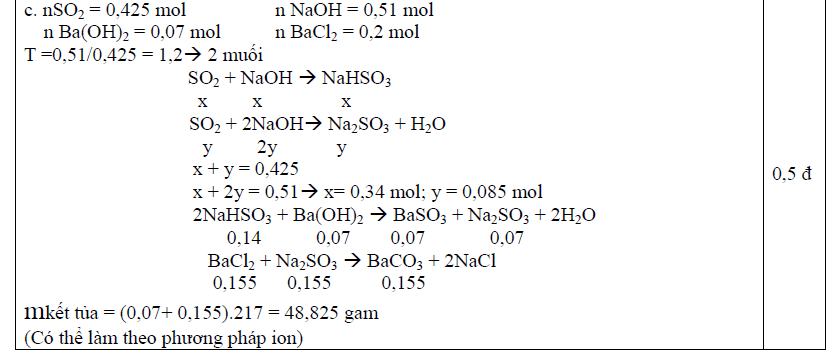
Trên đây là bộ đề kiểm tra Hóa 10 học kì 2 mà chúng tôi vừa gửi tới các bạn. Hi vọng với bộ tài liệu này, các bạn có thể sử dụng để ôn luyện lại các dạng bài tập. Đừng quên là bộ tài liệu sẽ đi kèm với đáp án, các bạn có thể sử dụng để so sánh để biết mình sai chỗ nào để rút kinh nghiệm cho các bài tập sau.




 056.3753648
056.3753648
 Chat FB
Chat FB