Tóm tắt tài liệu
Bảng tuần hoàn Hóa học 10 là một chương rất quan trọng, nó giúp cho các bạn hiểu thêm nhiều điều lí thú về các nguyên tố cũng như biết được vị trí của nguyên tố đó. Và cũng không ít bạn gặp khó khăn trong việc học chương này, chính vì thế chúng tôi đã tổng hợp bộ tài liệu bài tập Hóa 10 chương 2 có đáp án để tiếp sức cho các bạn trong quá trình học chương này. Hãy cùng nhau theo dõi tài liệu nhé.
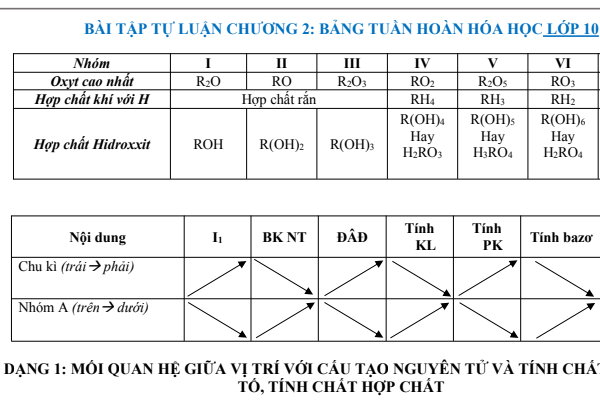
Bài tập Hóa 10 chương 2 có đáp án
Dạng 1: Mối quan hệ giữa vị trí với cấu tạo nguyên tử và tính chất nguyên tố, tính chất hợp chất
Bài 1: Cho nguyên tử có kí hiệu 16-32X
a/ Xác định các giá trị A, Z, p, n, e? Tên X? Cấu hình e?
b/ Xác định vị trí X trong bảng tuần hoàn?
c/ X là kim loại, phi kim hay khí hiếm? Giải thích?
d/ Hóa trị cao nhất với oxi? Công thức oxit cao nhất?
e/ Hóa trị với H trong hợp chất khí? Công thức hợp chất khí với H? (nếu có).
f/ Công thức hidroxit tương ứng? Cho biết nó có tính axit hay bazo?
Bài 2: Nguyên tố Y thuộc chu kì 3, nhóm VA.
a/ Y có bao nhiêu lớp e? Y có bao nhiêu e hóa trị? Các e hóa trị này thuộc lớp e nào?
b/ Viết cấu hình e nguyên tử của Y?
Bài 3: Nguyên tố X thuộc chu kì 4, nhóm IIIB.
a/ Y có bao nhiêu lớp e? X có bao nhiêu e hóa trị? Các e hóa trị này thuộc lớp e nào?
b/ Viết cấu hình e nguyên tử của X?
Dạng 2 : So sánh tính chất các nguyên tố lân cận và hợp chất oxit, hidroxit của chúng
Bài 1. Sắp xếp các nguyên tố sau: O, C, N, F, B, Be, Li theo chiều tăng dần tính phi kim? Giải thích?
Bài 2. Sắp xếp các nguyên tố sau: Na, Li, Cs, K, Rb theo chiều giảm dần tính kim loại? Giải thích?
Bài 3. Sắp xếp các nguyên tố sau: N, O, P, F theo chiều giảm dần tính phi kim? Giải thích?
Bài 4. Sắp xếp các nguyên tố sau: Na, K, Rb, Mg, Al theo chiều tăng dần tính kim loại? Giải thích?
Bài 5. Sắp xếp các nguyên tố sau: C, S, N, F, O, H, Si, Cl theo chiều tăng dần tính phi kim? Giải thích?
Bài 6. Sắp xếp các hợp chất sau theo chiều giảm dần tính bazo: Al2O3, Na2O, SiO2, MgO, SO3,P2O5, Cl2O7
Bài 7. Sắp xếp các hợp chất sau theo chiều tăng dần tính axit: NaOH, H2SiO3,HClO4, Mg(OH)2, Al(OH)3, H2SO4.
Dạng 3: Xác định hai nguyên tố cùng thuộc cùng 1 chu kì ở hai nhóm A liên tiếp
Bài 2: Phân tử X2Y có tổng số hạt proton là 23, biết X và Y ở hai ô liên tiếp trong 1 chu kì. Xác định X và Y, viết cấu hình e của X và Y, công thức hợp chất?
Bài 3 : Hai nguyên tố X và Y ở hai nhóm A liên tiếp trong BTH. Y thuộc nhóm VA. Ở trạng thái đơn chất X và Y không phản ứng với nhau. Tổng số proton trong hạt nhân của X và Y là 23. Xác định X, Y. Viết cấu hình e và xác định tính chất hóa học cơ bản của chúng?
Dạng 4 : Xác định hai nguyên tố cùng thuộc một nhóm A ở hai chu kì liên tiếp
Bài 1. Hai nguyên tố A và B thuộc cùng một nhóm A và ở hai chu kỳ liên tiếp của bảng tuần hoàn. Tổng số điện tích hạt nhân của A và B là 52.
a. Xác định A và B?
b. Viết cấu hình electron nguyên tử của A và B?
Bài 2. Hai nguyên tố A và B có tổng số điện tích hạt nhân là 58. Biết A và B thuộc cùng một phân nhóm và ở hai chu
kỳ liên tiếp của bảng tuần hoàn.
a. Xác định A và B?
b. Viết cấu hình electron nguyên tử của A và B?
Dạng 5 : Xác định tên nguyên tố dựa vào công thức oxit cao nhất và công thức hợp chất khí với hidro
Bài 1.
a) Oxit cao nhất của nguyên tố R thuộc nhóm IIA chứa 71,43
b) Hợp chất khí với H của nguyên tố R thuộc nhóm VA chứa 17,65
Bài 2. Hợp chất khí với hidro của một nguyên tử ứng với công thức RH4. Oxit cao nhất của nó chứa 53,3
Bài 3. Hợp chất khí với hidro của một nguyên tử ứng với công thức RH3. Oxit cao nhất của nó chứa 56,33
Bài tập trắc nghiệm
Câu 1. Vị trí của nguyên tử có cấu hình electron 1s2s2p3s3p5 trong bảng tuần hoàn là
A. ô thứ 17, chu kì 3, nhóm VIIA
B. ô thứ 17, chu kì 2, nhóm VIIA
C. ô thứ 16, chu kì 3, nhóm VIIA
D. ô thứ 12, chu kì 2, nhóm VIIA
Câu 2. Nguyên tố M có cấu hình electron phân lớp ngoài cùng là 3s. Vị trí của M trong bảng tuần hoàn là
A. ô thứ 10, chu kì 2, nhóm IIA
B. ô thứ 18, chu kì 3, nhóm VIIIA
C. ô thứ 11, chu kì 3, nhóm IA
D. ô thứ 12, chu kì 2, nhóm VIIA
Câu 3. Nguyên tố A có Z = 10, vị trí của A trong bảng tuần hoàn là
A. chu kì 1, nhóm VIIA
B. chu kì 2, nhóm VIIIA
C. chu kì 4, nhóm VIA
D. chu kì 3, nhóm IVA
Câu 14. Độ âm điện của các nguyên tố. F, Cl, Br, I xếp theo chiều giảm dần là
A. Cl > F > I > Br
B. I > Br > Cl > F
C. F > Cl > Br > I
D. I > Br > F > Cl
Câu 15. Bán kính nguyên tử các nguyên tố Na, Li, Be, B theo chiều tăng dần là
A. B < Be < Li < Na
B. Na < Li < Be < B
C. Li < Be < B < Na
D. Be < Li < Na < B
Câu 16. Sắp sếp theo chiều giảm dần bán kính nguyên tử của các nguyên tố sau 12Mg, 17Cl, 16S, 11Na
A. Na; Mg; S; Cl
B. Cl; S; Mg; Na
C. S; Mg; Cl; Na
D. Na; Mg; S; Cl
Câu 17. Tính axit tăng dần trong dãy
A. H3PO4; H2SO4; H3AsO4.
B. H2SO4; H3AsO4; H3PO4.
C. H3PO4; H3AsO4; H2SO4.
D. H3AsO4; H3PO4; H2SO4.
Câu 18. So sánh tính bazơ của các oxit sau Na2O, Al2O3, MgO, SiO2.
A. Na2O > Al2O3 > MgO > SiO2.
B. Al2O3 > SiO2 > MgO > Na2O.
C. Na2O > MgO > Al2O3 > SiO2.
D. MgO < Na2O < Al2O3 < SiO2.
Một số câu hỏi trắc nghiệm trong đề thi ĐHCĐ
Câu 5: Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì (ĐH khối B – 2007)
A. tính kim loại tăng dần, độ âm điện tăng dần
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, bán kính nguyên tử giảm dần. Câu 6: Trong hợp chất ion XY (X là kim loại, Y là phi kim), số electron của cation bằng số electron của anion và tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có một mức oxi hóa duy nhất. Công thức của XY là
A. AlN
B. NaF
C. LiF
D. MgO (ĐH khối B – 2007)
Câu 7: Bán kính nguyên tử của các nguyên tố: 3 8 9 11 Li, O, F, Na được xếp theo thứ tự tăng dần từ trái qua phải là
A. F, O, Li, Na
B. F, Na, O, Li
C. F, Li, O, Na
D. Li, Na, O, F (ĐH khối A – 2008)
Câu 8: Công thức phân tử của hợp chất khí tạo bởi nto R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,04
A. S
B. As
C. N
D. P (ĐH khối B – 2008)
Câu 9: Tổng số hạt p, n, e, của nguyên tử X là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu hóa học và vị trí của X (chu kỳ, nhóm) là
A. Na, chu kỳ 3, nhóm IA
B. Mg, chu kỳ 3, nhóm IIA
C. F, chu kỳ 2, nhóm VIIA
D. Ne, chu kỳ 2, nhóm VIIIA
Câu 26: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a
A. Oxit cao nhất của R ở điều kiện thường là chất rắn.
B. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
C. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
D. Phân tử oxit cao nhất của R không có cực.
Câu 27: X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
A. Độ âm điện của X lớn hơn độ âm điện của Y.
B. Đơn chất X là chất khí ở điều kiện thường.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
(ĐH khối A – 2012)
Câu 28: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là (CĐ khối A, B – 2013)
A. 7.
B. 6.
C. 8.
D. 5.
Câu 29: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là (ĐH khối A – 2013)
A. 1s22s22p53s2
B. 1s22s22p63s1
C. 1s22s22p63s2
D. 1s22s22p43s1
Câu 30: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là (ĐH khối A – 2014)
A. Al (Z = 13)
B. Cl (Z = 17)
C.O (Z = 8)
D. Si (Z = 14)
Vậy là chúng ta đã cùng nhau đọc qua bộ tài liệu bài tập Hóa 10 chương 2 có đáp án với đầy đủ các phân dạng và bài tập cho từng dạng cụ thể, tin rằng bộ tài liệu sẽ giúp ích cho các bạn rất nhiều trong quá trình học tập và rèn luyện ở chương Bảng toàn hoàn nguyên tố hóa học này. Các bạn hãy chú ý theo dõi chúng tôi nhé, sẽ có rất nhiều tài liệu hay đấy. Chân thành cảm ơn các bạn đã đọc.



 056.3753648
056.3753648
 Chat FB
Chat FB