Tóm tắt tài liệu
Trong chương trình hóa học lớp 10, chúng ta gặp khá nhiều câu trắc nghiệm hay, lạ và rất khó. Tuy nhiên, để giải quyết được tất cả câu hỏi khó đó thì các phần cơ bản chúng ta phải nắm thật chắc, tránh sai sót lặt vặt. Tài liệu dưới đây bao gồm khá nhiều bài tập cấu hình electron nguyên tử trong chương trình hóa học 10. Các bài tập đề có đáp án chi tiết. Bạn đọc hoàn toàn có thể tải về để xem thêm nhé.





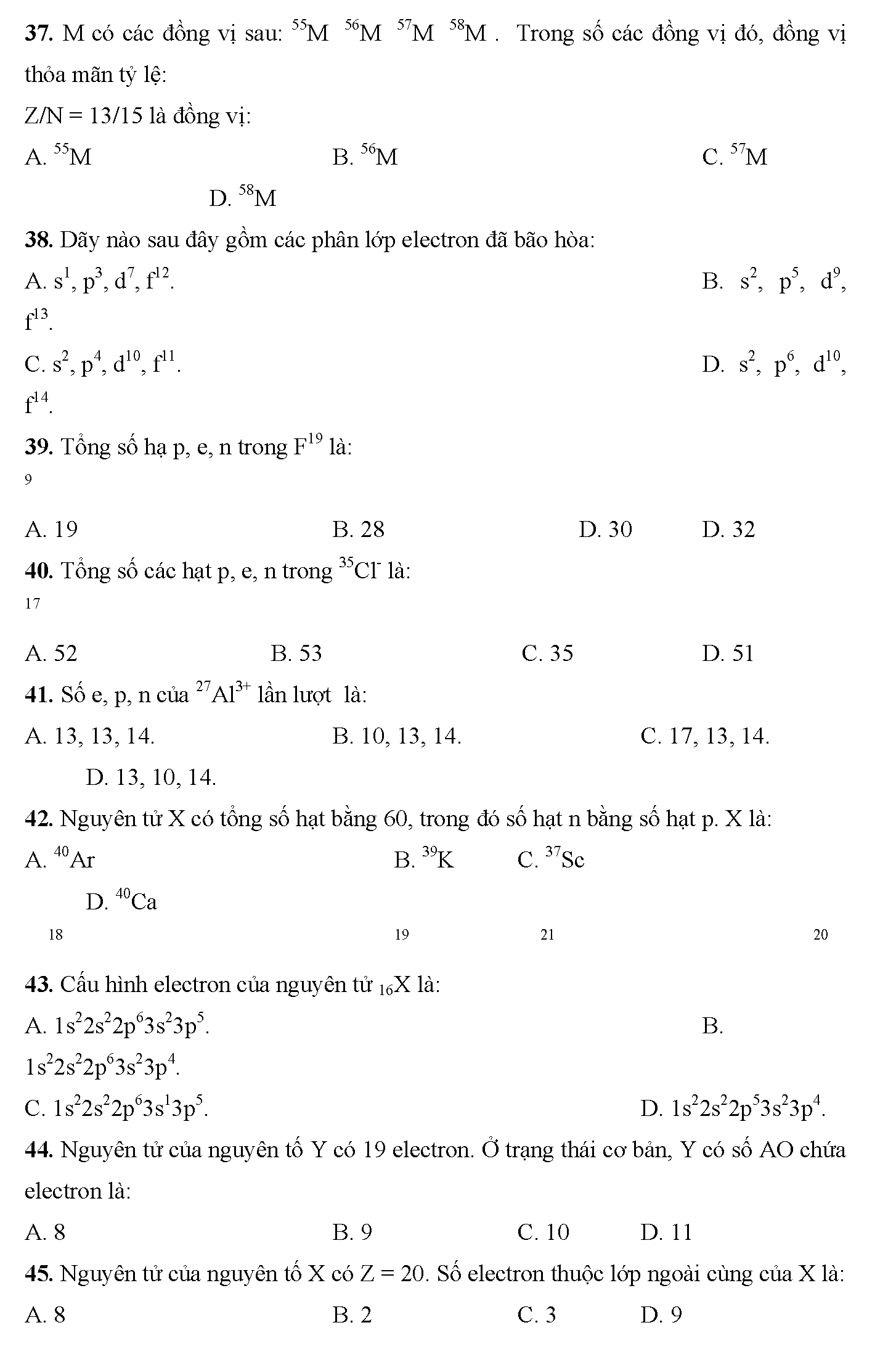










Bài tập trắc nghiệm cấu hình electron nguyên tử
1. Nguyên tố hóa học là:
A. những nguyên tố có cùng điện tích hạt nhân.
B. những nguyên tố có cùng số khối
C. những hạt có cùng số nowtron.
D. những phân tử có cùng số phân tử khối
2. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là:
A. electron và proton.
C. nơtron và electron.
B. proton và nơtron.
D. electron, nơtron và proton.
3. Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. electron và proton.
C. nơtron và electron.
B. proton và nơtron.
D. electron, nơtron và proton.
4. Nguyên tố hóa học là những nguyên tử có cùng:
A. số khối
B. số nơtron
C. số proton
D. số nơtron và proton
5. Kí hiệu nguyên tử đầy đủ dặc trưng cho nguyên tử của một nguyên tố hóa học vì nó cho biết:
A. số khối A
C. nguyên tử khối của nguyên tử
B. số nơtron
D. số khối A và số đơn vị điện tích hạt nhân
6. Đồng vị là những:
A. hợp chất có cùng điện tích hạt nhân.
B. nguyên tố có cùng điện tích hạt nhân.
C. nguyên tố có cùng số khối A.
D. nguyên tử có cùng điện tích hạt nhân và khác nhau về số khối.
7. Nguyên tử là phần nhỏ nhất của chất:
A. không mang điện.
B. mang điện tích dương.
C. mang điện tích âm.
D. có thể mang điện hoặc không mang điện.
8. Số hiệu nguyên tử cho biết:
A. số proton trong hạt nhân nguyên tử hay số đơn vị điện tích hạt nhân nguyên tử.
B. số electron trong vỏ nguyên tử.
C. số thứ tự nguyên tố trong bảng tuần hoàn.
9. Obitan nguyên tử hiđro ở trạng thái cơ bản có dạng hình cầu và có bán kính trung bình là:
A. 0,045 nm.
B. 0,053 nm.
C. 0,098 nm.
D. 0,058 nm.
10. Obitan py có dạng hình số 8 nổi:
A. được định hướng theo trục z.
C. được định hướng theo trục x.
B. được định hướng theo trục y.
D. không định hướng theo trục nào.
11. Trong nguyên tử hiđro, electron thường được tìm thấy:
A. Trong hạt nhân nguyên tử.
B. Bên ngoài hạt nhân, song ở gần hạt nhân vì electron bị hút bởi hạt proton.
C. Bên ngoài hạt nhân và thường ở xa hạt nhân, vì thể tích nguyên tử là mây electron của nguyên tử đó.
D. Cả bên trong và bên ngoài hạt nhân, vì electron luôn được tìm thấy ở bất kỳ chỗ nào trong Nguyên tử.
12. Các obitan trong một phân lớp elecron:
A. có cùng sự định hướng trong không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
13. Nguyên tử khối của clo là 35,45. Khối lượng (tính bằng kg) của một nguyên tử magiê là:
A. 58,864. 10-27
C. 59,000. 10-27
B. 58,856. 10-27
D. 59,100. 10-27
14. Nguyên tử khối của magiê là 24,31. Khối lượng (tính bằng kg) của một nguyên tử magiê là:
A. 40,37.10-27
C. 40,61.10-27
B. 40,36.10-27
D. 40,62. 1027
15. Nguyên tử A có tổng các hạt p, e, n là 36. Số hạt mang điện nhiều hơn số hạt không man điện 2 lần. Số hạt p, n, e của A lần lượt là:
A. 12, 12, 12
B. 8, 8, 8
C. 6, 6, 6
D. 3, 6, 6
16. Nguyên tử Y có tổng số hạt p, n, e là 28. Số hạt mang điện nhiều hơn số hạt không mang điện là 8. Cấu hình
electron của Y là:
A. 1s22s22p6.
B. 1s23s23p3.
C. 1s22s22p3.
D. 1s22s22p2.
17. Kết quả phân tích cho thấy trong phân tử H2O có 88,81
A. 1,080 u.
B. 1,800 u.
C. 1,008 u .
D. 1,000 u.
18. Trong tự nhiên brom có 2 đồng vị bền là 79Br chiếm 50,69
A. 79,990
B. 80,000
C. 79,986
D.79,689
19. Oxi có 3 đồng vị là: 16O; 17O; 18O. Hidro có 2 đồng vị là 1H và 2H. số loại phân tử nước có thể tạo thành từ các đồng vị trên là:
A. 9
B. 12
C. 18
D. 24
20. Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27
A. 73
B. 32,15
C. 63
D. 64,29
21. Trong tự nhiên đồng vị 37Cl chiếm 24,23
A. 8,92
B. 8,56
C.9,82
D. 8,65
23. Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron của nguyên tử X
là:
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p4.
C. 1s22s22p63s13p5.
D. 1s22s22p43s23p6.
24. Nguyên tử X có electron cuối cùng được điền vào phân lớp 4s1. Số proton của X là:
A. 29
B. 19
C. 20
D. 18
25. Nguyên tử 15A có số electron độc thân là:
A. 2
B. 4
C. 3
D. 5
26. Nguyên tử 26Y có số electron độc thân là:
A. 2
B. 3
C. 3
D. 4
27. Nguyên tử 24X có số electron độc thân là:
A. 6
B. 5
C. 4
D. 1
28. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp thứ 3 có 5 electron. Số đơn vị diện tích hạt
nhân nguyên tử X là:
A. 16
B. 15
C. 13
D. 7
29. Nguyên tử của nguyên tố X có 4 lớp electron. Lớp thứ 4 có 2 electron. Số đơn vị điện tích hạt
Nhân của nguyên tử X là:
A. 20
B. 26
C. 20 hoặc 26
D. 17
Đáp án trắc nghiệm
1A 2B 3D 4C 5D 6D 7A 8D (cả A,B và C ) 9B 10B 11B 12B 13B 14A 15A 16 A ( 2 2 5 1s 2s 2p ) 17C 18C 19A 20D 21A 22(đề thiếu) 23B 24B 25C 26D 27A 28B 29C 31C 32D 33B 34B 35B 37B 38D 39B 40A 41D 42D 43B 44C 45B 46C 47A 48B 49B 50A 51C 52B 53C 53C 55B 56A 57A 58D 59D 60C 61D 62A 62b)C 63D 64C 65B 66C 67a).C 67b).D 68D 69D 70D 71C 72C 73A 74B 75B 76C 77a)B 77b)C 78B 79C 80C 81A 82B 83D 84C 85C 86B 87D 88C 89B 90B 91B 92B 93B 94C 95C 96C 97B 98B 99D 100D 101C 102C 103B 104B
Qua tài liệu trên, mong rằng các bạn có thêm một số bài tập trắc nghiệm phần cấu tạo electron nguyên tử để luyện tập thêm trước khi bước vào các kì thi quan trọng. Chúc các bạn hoàn thành thật tốt các bài tập trên.
Tham khảo
- https://vi.wikipedia.org/wiki/C%E1%BA%A5u_h%C3%ACnh_electron
- https://www.youtube.com/watch?v=ELXJY1OmOeU




 056.3753648
056.3753648
 Chat FB
Chat FB